BALANCEO DE ECUACIONES QUÍMICAS
INTRODUCCIÓN
En este trabajo se mostrara información acerca del balanceo de ecuaciones químicas y procedimientos para poderlas desarrollar
partes que conforman una ecuación química, así como la ley de conservación de la materia que a continuación se mencionara. Lo que quiere decir es que los átomos en una ecuación química se reorganizan, obteniendo el mismo número de átomos en los reactivos y productos.
OBJETIVO GENERAL
Aprender y reconocer los métodos para balancear las ecuaciones:tanteo y oxido reducción
OBJETIVOS ESPECÍFICOS
1 conocer los coeficientes que balancean la ecuación, estos coeficientes indican las relaciones molares que se guardan entre las sustancias,
2 hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos.
desarrollar las ecuaciones de la pagina Laboratorio virtual de balanceo de ecuaciones.
MARCO TEÓRICO
Balancear una ecuación química es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa.
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química.
No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia.
Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
Para balancear una ecuación química, se debe considerar lo siguiente:
Conocer las sustancias reaccionantes y productos.
Los subíndices indican la cantidad del átomo indicado en la molécula.
Los coeficientes afectan a toda la sustancia que preceden.
El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua .
BALANCEO POR TANTEO
El método por tanteo se basa en el balance de masa de los coeficientes. Se busca igualar la cantidad de átomos de una ecuación química sin alterar las sustancias de la reacción. Este método es de gran utilidad para balancear ecuaciones sencillas en donde la reacción no es demasiado extensa. De esta manera se puede realizar una inspección de cuantos átomos se encuentran en un lado y cuantos hacen falta para que halla una igualdad al otro lado de la ecuación.
Se emplea para balancear ecuaciones sencillas. Se realiza al "cálculo"
tratando de igualar ambos miembros.
tratando de igualar ambos miembros.
Para ello utilizaremos el siguiente ejemplo para balancear:
PASOS PARA EL BALANCEO DE UNA ECUACIÓN POR TANTEO
N2 + H2 -- NH3
Identificamos las sustancias que intervienen en la reacción.
En este caso el nitrógeno y el hidrógeno para obtener amoniaco.
Se verifica si la ecuación está balanceada o no.
En este caso notamos que ambos
miembros no tienen la misma cantidad de átomos.
Por lo tanto no está balanceada.
En este caso notamos que ambos
miembros no tienen la misma cantidad de átomos.
Por lo tanto no está balanceada.
Se balancea la ecuación colocando coeficientes delante de las fórmulas o símbolos
que los necesitan.
Empezar con los elementos metálicos o por el que se encuentra
presente en menos sustancias:
Primero balanceamos el nitrógeno:
que los necesitan.
Empezar con los elementos metálicos o por el que se encuentra
presente en menos sustancias:
Primero balanceamos el nitrógeno:
N2 + H2 -- 2 NH3
El hidrógeno y oxígeno quedarán para el final.
Seguidamente balanceamos el hidrógeno:
Seguidamente balanceamos el hidrógeno:
N2 + 3 H2 -- 2 NH3.
Si un coeficiente no es entero, entonces debe multiplicar todos
por el mayor de los denominadores.En este caso no ocurre.
Como es un tanteo, debe recordar que las reglas indicadas, son recomendaciones.
Aún así, para cualquier ejercicio, empiece usted,
por donde desee pero tomando como parámetro.
Que el número de átomos de este elemento está definido en uno de los miembros.
por el mayor de los denominadores.En este caso no ocurre.
Como es un tanteo, debe recordar que las reglas indicadas, son recomendaciones.
Aún así, para cualquier ejercicio, empiece usted,
por donde desee pero tomando como parámetro.
Que el número de átomos de este elemento está definido en uno de los miembros.
SEGUNDA ECUACION
Fe+Cl2→FeCl3
1. Verifica la igualdad de la ecuación sumando los átomos de ambos lados. En este caso vemos que para Fe (Hierro) corresponde 1 átomo al no haber subíndice indicador. Entonces la cuenta a efectuar
Fe+Cl2→FeCl3 1+2→1+3
De esta manera, puesto que 3 es menor que 4,es necesario balancear la ecuación.
2. Ordenamos los elementos de ambos lados de la ecuación e identificamos el número de átomos.
Fe+Cl2→FeCl3
Lado Izq. Fe=1 Cl=2 Lado der. Fe=1 C=3
3. Iniciamos por el Hierro (Fe), se encuentra balanceado pero dado que la sustancia obtenida tiene más átomos de Cloro, entonces trabajaremos con 2 moléculas de Hierro para afectar las cantidades de ambos. De esta manera
2Fe+Cl2→2FeCl3
Lado Izq. Fe=2 Cl=2 Lado der. Fe=2 C=6
Hemos modificado Fe e igualado a ambos lados de la ecuación. Esto afecta a Cl, entonces pasaremos a igualarlo
4. Con 3 moléculas de Cl, obtienes la misma cantidad de átomos del lado derecho, entonces se balancea de la siguiente manera
2Fe+3Cl2→2FeCl3
Lado Izq. Fe=2 Cl=6 Lado der. Fe=2 C=6
Ahora solo nos queda verificar la igualdad en nuestro balanceo de ecuaciones químicas por tanteo
2Fe+3Cl2→2FeCl3
Lado Izq. 2 + 6 Lado der. 2 + 6
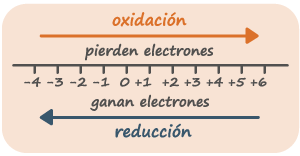
BALANCEO POR OXIDO REDUCCIÓN
El método es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos
Una reacción de óxido reducción se da con la pérdida o ganancia de electrones, lo cual incluye cualquier reacción inorgánica (oxidación o reducción de metales), orgánica (combustión de combustible ya sea gasolina, madera o carbón) e incluso en seres vivos donde la reacción óxido reducción se manifiesta en el metabolismo (el consumo y transformación de alimentos en energía), La oxidación se define como un proceso en el que una sustancia cede a otra uno o mas electrones y aumenta así su numero de oxidación, mientras que la reducción corresponde al proceso en el cual una sustancia capta de otra uno o mas electrones, por lo que disminuye su numero de oxidación.
PASOS PARA EL BALANCEO DE UNA ECUACION POR OXIDO REDUCCION
- Se debe tener en cuenta el Procedimiento para balancear ecuaciones por el método de Oxido reducción. Para ilustrar paso a paso el procedimiento a seguir, analizaremos la reacción entre el ácido nítrico y el sulfuro de hidrógeno, con producción de monóxido de nitrógeno, azufre y agua HNO₃ + H₂S ------- NO + S + H₂O
- PASO 1: asignar los numeros de oxidacion correspondientes a cada elemento
- Paso 2: Observar e identificar cuáles fueron los elementos correctamente el que experimentaron cambios número de oxidación a en los estados de oxidación y todos los átomos que con ellos plantear participan en la semirreacciones.
- H⁺ N⁵⁺ O₃⁼ + H₂⁺S⁼ ------N⁺⁺ O⁼ + S⁰ + H₂⁺ O⁼
- N⁵⁺ + 3 e⁻ ------- N⁺⁺ se redujo
- S⁼ ------- S⁰ + 2 e⁻ , se oxidó.
- Paso 3: Igualar la cantidad de electrones perdidos y ganados. Para ello, se multiplica la ecuación (1) por el número de electrones perdidos en la ecuación (2), y la ecuación (2) por el número de electrones ganados en la ecuación (1)
- Paso 4: verificar los coeficientes para las especies no contempladas en el paso anterior, es decir, H y O. En caso de estar des balanceados, se procede según el método de tanteo.
- 2(N⁵⁺ + 3 e⁻ ------- N⁺⁺ )
- 3(S⁼ ------- S⁰ + 2 e⁻ )
- 2HNO₃ + 3H₂S ------- 2NO + 3S + 4H₂O Paso 4:
¿Por qué tenemos que equilibrar la reacción química?
La ecuación química equilibrada describe exactamente las cantidades de los reactantes y productos en una reacción química. La ley sobre la conservación de la masa dice que en la reacción química la masa no se puede ni producir ni destruir. Esto significa que la ecuación química debe tener por ambos lados el mismo número de átomos de cada elemento. Para que una ecuación esté equilibrada, las sumas de las cargas eléctricas en ambos lados tienen que ser idénticas.
Instrucciones para equilibrar las ecuaciones redox
- Paso 1. Se escribe una reacción desequilibrada
- Paso 2. Se desmonta la reacción redox a las reacciones parciales
- a) Se determinan los números de la oxidación de cada átomo respectivo.
- b) Se identifican los pares redox en la reacción
- c) Se combinan los pares redox en dos reacciones parciales
- Paso 3. Se equilibran los átomos en las ecuaciones parciales
- a) Se equilibran todos los átomos excepto del H y del O
- b) Se equilibran las cargas añadiendo H+ o OH-
- b) Se equilibran los átomos del oxígeno añadiendo H2O
- Paso 4: Se iguala el número de los electrones perdidos y recibidos en las reacciones parciales
- Paso 5: Se suman las ecuaciones parciales
- Paso 6: Se acorta la ecuación
- Y al final, siempre se verifica el equilibrio de las cargas y de los elementos.
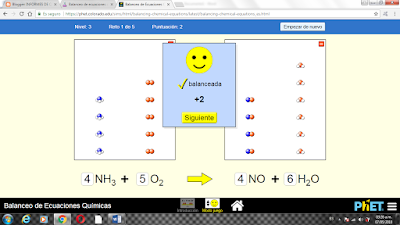
LABORATORIO QUIMICO VIRTUAL
NIVEL 1
NIVEL 2
NIVEL 3
PUNTAJE FINAL
CONCLUSIÓN
Al concluir esta investigación seremos capaces de balancear correctamente cualquier ecuación química por el proceso de tanteo y oxido reducción , así como
también podremos reconocer si una ecuación química se encuentra correctamente balanceada.
también podremos reconocer si una ecuación química se encuentra correctamente balanceada.
webgrafia
https://phet.colorado.edu/sims/html/balancing-chemical-equations/latest/balancing-chemical-equations_es.html
http://html.rincondelvago.com/balanceo-de-ecuaciones-quimicas.html
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Balanceo_de_ecuaciones
http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=248





















No hay comentarios:
Publicar un comentario