NEUTRALIZACION
INTRODUCCIÓN:
En este trabajo se hablara de neutralizacion y su relacion con la quimica y mostrando las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
OBJETIVO GENERAL
Aprehender con el programa yenka su relación con la química y la vida cotidiana
OBJETIVOS ESPECIFICOS
1) Mostrar los ejemplos en Laboratorio Yenka
2) Aprender las reacciones que tiene entre un acido y una base
MARCO TEÓRICO
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua.
La ecuación general que representa este tipo de reacción es:

Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
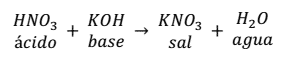
Como se puede observar en la reacción, la sal se forma entre el anión (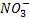 ) del ácido y el catión (K+).
) del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido sulfúrico y el hidróxido de sodio.
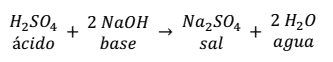
Como se puede observar en la reacción, la sal se forma entre el anión (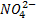 ) del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
) del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre ácidos fuertes y bases fuertes, es siempre la misma.
Reacciones de neutralización
Las reacciones de neutralización, son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Características
Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción en la que, generalmente, se forman agua y sal, es muy rápida.
Identificación
Para identificar las reacciones de neutralización se utilizan indicadores ácido-base, como la Fenolftaleína, el Tornasol, etc.
Estos indicadores son sustancias que poseen la capacidad de cambiar su coloración según el grado de acidez de una disolución (pH). Así la Fenolftaleína que en presencia de bases (pH>7) adquiere un color rojo violáceo, pierde su color al agregar un ácido a esta disolución, lo que demuestra que el grado de acidez disminuyó y con ello se neutralizó el carácter básico.
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad
Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
El valor del pH, definido como el – log[H+], cuando los equivalentes del ácido y de la base son iguales, se le conoce como punto de equivalencia. El punto de equivalencia puede ser práctico, o teórico.
En el pH, la escala del 0 al 7, es medio ácido, y del 7 al 14, medio básico, siendo el valor en torno al 7, un pH neutro.
Si valoramos la reacción entre un ácido fuerte y una base fuerte, el punto equivalente teórico estará en torno a 7, produciéndose una total neutralización de la disolución. En cambio, si se estudia un ácido débil con una base fuerte, la sal que se produce se hidrolizará, añadiendo a la disolución iones OH-, por lo tanto el punto de equivalencia será mayor que 7. Y si es el caso de un ácido fuerte con una base débil, la sal que se produce se hidroliza añadiendo los iones hidronios, siendo asñi el punto de equivalencia menos que 7.
Cuanto más cerca se encuentren los valores de los puntos teóricos y prácticos, menor será el error cometido.
Los ácidos fuertes, son aquellas sustancias que se disocian totalmente, cuando se disuelven en agua. Son ácidos fuertes el H2SO4, HCl, HNO3, etc.
pH= -log [H+] = -log[ Ac. Fuerte]
Ácidos de fuerza media: son aquellos que se disocian parcialmente, sus constantes ácidas o de disociación son mayores de 1 x 10^-3
Ácidos débiles: Son aquellos que no se disocian completamente. Cuando más pequeña es la constante ácida, más débil es la acidez.
Bases fuertes: se disocian totalmente, cediendo todos sus OH-. Bases fuertes son los metales alcalinos, y alcalinotérreos como pueden ser NaOH, KOH, Ba(OH)2, etc
pH= 14 + log [OH-]
Bases débiles: Se trata de aquellas que no se disocian completamente.
Existen unas sustancias, llamadas indicadores, que generalmente son ácidos orgánicos débiles, éstas poseen la propiedad de cambiar de color cuando cambia la acidez de la disolución donde se encuentran.
Por ejemplo, el papel tornasol, cambia a color azul al ser introducido en una disolución de carácter básico, y a color rojo, si la disolución es ácida.
LABORATORIO YENKA
ÁCIDO CLORHÍDRICO +HIDRÓXIDO DE POTASIO →AGUA+CLORURO DE POTASIO HCl+KOH→H2O+KCl
ÁCIDO NITRITO+HIDROXIDO DE POTASIO →AGUA+NITRATO DE POTASIO
HNO2+KOH→H2O+KNO3
ION SULFATO ÁCIDO --ION SULFATO+ION SULFATO DE SODIO
SO4-2+(Na2SO4)
ACIDO CLORHIDRICO+HIDROXIDO DE SODIO →AGUA+CLORURO DE SODIO
HCl+NaOH → H2O+NaCl
CONCLUSIÓN
Finalmente Una valoración ácido-base es una técnica que permite conocer la concentración de una disolución de una sustancia que pueda actuar como ácido neutralizada por medio de una base de concentración conocida, o viceversa. Se basa en una reacción de neutralización.
Gracias a la neutralización de NaOH y HCl conseguimos calcular el pH de la disolución de NaOH
La experiencia puede concluirse que haciendo reaccionar un ácido con una base, se produce una neutralización donde el pH se equilibra llegando a valer 7 y obteniéndose una sal y a su vez, agua. Suelen ser reacciones exotérmicas donde se libera calor.
pH INDICADORES
En este trabajo se mostrara un indicador de pH que permite medir el pH de un medio mostrando que habitualmente, se utilizan como indicador de las sustancias químicas que cambian su color al cambiar el pH de la disolución.
OBJETIVO GENERAL
Aprehender con el programa yenka su relación con la química y la vida cotidiana
OBJETIVOS ESPECÍFICOS
1) Mostrar los ejemplos en Laboratorio Yenka
2) Aprender como La fenolftaleína, de fórmula C₂₀H₁₄O₄, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disolución
3)2) Aprender el indicador universal como una sustancia que mide el pH intermedio
FERNOLFTALEINA
3)2) Aprender el indicador universal como una sustancia que mide el pH intermedio
MARCO TEÓRICO
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color azul (chiclamino)con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado). Sin embargo, en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración: la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.
La fenolftaleína, de fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color azul (chiclamino)con un punto de viraje entre pH=8,2 (incoloro) y pH=10 (magenta o rosado). Sin embargo, en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración: la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.
Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico. Usos de la Fenolftaleína Se utiliza frecuentemente como indicador de pH no extremos, ya que en disoluciones ácidas (no extremadamente muy ácidas) permanece incoloro, pero en presencia de disoluciones básicas (no extremadamente muy básicas) se torna color rosa. En química se utiliza en análisis de laboratorio, investigación y química fina.
La acción del fármaco es semejante al grupo del antraceno y ejerce un efecto estimulante del peristaltismo intestinal por acción directa sobre las terminaciones nerviosas del colon. Como es un compuesto insoluble en agua pero que forma sales solubles con los álcalis, su acción depende hasta cierto grado de la alcalinidad del tracto gastrointestinal.
La fenolftaleína de fórmula (C20H14O4) es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en presencia de disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,0 (incoloro) a pH=9,8 (magenta o rosado). Sin embargo en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración; en la cual la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.
Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico.

Los cambio de color estan dados por los rangos de pH en cual es utilizada, las cuales son descritas mediante las siguientes ecuaciones químicas:
De medio neutro a medio básico:
H2Fenolftaleína + 2 OH- ↔ Fenolftaleína2- + 2 H2O
Incoloro → Rosa
De medio básico a medio muy básico:
Fenolftaleína2- + OH- ↔ Fenolftaleína(OH)3-
Rosa → Incoloro
De medio básico a medio neutro o ácido:
Fenolftaleína2- + 2 H+ ↔ H2Fenolftaleína
Rosa → Incoloro
De medio neutro o ácido a medio muy ácido:
H2Fenolftaleína + H+ ↔ H3Fenolftaleína+
Incoloro → Naranja
La fenolftaleína normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa. El cambio de color no puede explicarse solo basándose en la desprotonación, se produce un cambio estructural con la aparición de una tautomería cetoenólica.
LABORATORIO YENKA
UNIVERSAL
Este trabajo hablara del universal indicador de pH como sustancia que permite medir el pH de un medio. Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
MARCO TEÓRICO
Un indicador universal es un indicador de pH hecho de una solución de varios compuestos que exhibe varios cambios de color suaves en un amplio rango de valores de pH para indicar la acidez o alcalinidad de las soluciones. Aunque hay varios indicadores universales de pH disponibles en el mercado, la mayoría son una variación de una fórmula patentada por Yamada en 1933.
Los detalles de esta patente se pueden encontrar en Chemical Abstracts . [ Los experimentos con el indicador universal de Yamada también se describen en el Journal of Chemical Education .
Un indicador universal está compuesto típicamente de agua, , fenolftaleína sódica sal, hidróxido de sodio, rojo de metilo , bromotimol azul sal monosódica y timol azul sal monosódica. Los colores que indican el pH de una solución, después de agregar un indicador universal, son:
rango de pH Descripción Color
<3 Ácido fuerte rojo
3–6 Ácido débil Naranja o amarillo
7 Neutral Verde
8–11 Base débil Azul
> 11 Base fuerte Violeta o añil
Los colores de amarillo a rojo indican una solución ácida, los colores de azul a violeta indican las bases y el color verde indica que una solución es neutra.
Componentes indicadores universales
Indicador Color de pH bajo Rango de pH de transición Color de pH alto
Timol azul (primera transición) rojo 1.2 - 2.8 Amarillo
Naranja de metilo rojo3.2 - 4.4 Amarillo
Rojo de metilo Amarillo 4.8 - 6.0 rojo
Azul de bromotimol Amarillo 6.0 - 7.6 Azul
Timol azul (segunda transición) Amarillo 8.0 - 9.6 Azul
Fenolftaleína Incolo 8.3 - 10.0 Fucsia
También están disponibles papeles de prueba de pH de amplio rango con distintos colores para cada pH de 1 a 14. Las tablas de coincidencia de colores se suministran con las tiras reactivas específicas compradas.
Tipos
Cambio de color de un indicador universal después de sumergirlo en una solución básica de hidróxido de sodio (NaOH)
Kit de prueba indicador universal
Cambio de color del indicador universal después de sumergirlo en una solución neutra.
Un indicador universal es colectivamente una mezcla de indicadores que muestran un cambio de color en una solución, que interpreta qué tan ácida o básica es una solución. Un indicador universal puede estar en forma de papel o presente en forma de solución. [5]
Forma del papel: es una tira de papel de color que cambia de color a rojo si la solución es ácida y a azul si la solución es básica. La tira se puede colocar directamente sobre la superficie de una sustancia húmeda o se pueden dejar caer algunas gotas de la solución sobre el indicador universal utilizando equipo para dejar caer. Si la solución de prueba es de un color oscuro, es preferible utilizar un indicador universal de papel.
Solución: Los componentes principales de un indicador universal, en forma de solución, son azul de timol , rojo de metilo , azul de bromotimol y fenolftaleína . Esta mezcla es importante porque cada componente pierde o gana protones dependiendo de la acidez o basicidad de la solución que se está probando. Es beneficioso utilizar este tipo de indicador universal en una solución incolora. Esto aumentará la precisión de la indicación.
TORNASOL
El tornasol es uno de los más conocidos indicadores de pH.
Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece solo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases.
Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleína.
(impregnado) en papel poroso. El papel de tornasol puede presentarse en tres colores diferentes: rojo, azul o neutro.
El tornasol rojo se utiliza para probar las bases; el tornasol azul para probar ácidos y el tornasol neutro para probar ambos. El papel de tornasol cambia de color al ponerse en contacto con una solución particular. Ejemplo: el papel de tornasol azul, en presencia de una solución ácida, cambia el color de azul a rojo. Esto es porque los iones reaccionan cambiando la disposición de los átomos presentes en el indicador. El papel tornasol rojo en contacto con una base, cambia del color rojo para el azul. El papel neutro, en contacto con ácidos, se vuelve rojo; en contacto con bases, se vuelve azul.
LABORATORIO YENKA
CONCLUSIÓN
Finalmente Los indicadores de pH normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa.El ndicador universal de pH es la sustancia que permite medir el pH de un medio. .Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
TITULACIÓN
INTRODUCCIÓN:
En este trabajo se hablara de titutlaciony su método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida.
OBJETIVO GENERAL
Aprehender con el programa yenka su relación con la química y la vida cotidiana
OBJETIVOS ESPECIFICOS
1) Mostrar los ejemplos en Laboratorio Yenka
2) Aprender la concentracion desconocidad de un reativo a partir de una reactivo con concentracion conocida








http://www.escuelapedia.com/el-papel-tornasol/
http://ciencia-basica-experimental.net/titulacion.htm
https://es.answers.yahoo.com/question/index?qid=20100131023924AAyM7VE
http://www.eis.uva.es/~qgintro/nomen/tutorial-09.html
https://doc-0g-80-docs.googleusercontent.com/docs/securesc/edpru4gqnm66brhavqak13fhvao4q4d8/lgq9fav7nuql1k6m625j62tn9tgom6uk/1541620800000/05285166965225682650/13836789518241930654/1B6NMCcVAYv1uuPBkKdrDPg_9bNTf6bkO?e=download&nonce=n3e1d6pd81rhe&user=09443605587336899398&hash=5tccng1v2rlcagb1e5enscjmh1j33t14
MARCO TEÓRICO
La naturaleza de las sustancias es una de los temas más estudiados por la química, ya que de acuerdo a ésta, están determinados los tipos de reacciones que se presentan de acuerdo a los reactivos en un proceso.
La titulación es un método para determinar la cantidad de una sustancia presente en solución. Una solución de concentración conocida, llamada solución valorada, se agrega con una bureta a la solución que se analiza. En el caso ideal, la adición se detiene cuando se ha agregado la cantidad de reactivo determinada en función de un cambio de coloración en el caso de utilizar un indicador interno, y especificada por la siguiente ecuación de la titulación.
NA VA = NB VB
A este punto se le llama punto de equivalencia (Umland, 2000, p.139).
En términos generales la reacción entre cantidades equivalentes de ácidos y bases se llama neutralización o reacción de neutralización, la característica de una reacción de neutralización es siempre la combinación de hidrogeniones que proceden del ácido, con hidroxiliones procedentes de la base para dar moléculas de agua sin disociar, con liberación de energía calorífica como calor de neutralización y formación de una sal.
En una expresión como la siguiente expresión:
Ácido + Base → Sal + Agua
Un caso particular sería la reacción entre un ácido fuerte (HNO3) y una base débil (Na2CO3).
2HNO3 + Na2CO3 → 2 NaNO3 + CO2↑ + H2O
Así pues, la titulación es un proceso en el cual la solución estándar (del patrón primario) se combina con una solución de concentración desconocida para determinar dicha concentración, la curva de titulación es la gráfica que indica como el pH de la solución cambia durante el transcurso de la misma (el pH se gráfica contra el volumen de base o ácido agregado).
Entonces podría entenderse como final de la titulación al momento en que el pH llegase a 7, sin embargo, esto está en función de la “fuerza” del ácido o la base que se están titulando.
Así cuando la neutralización se produce entre un ácido fuerte y una base fuerte. El pH en el punto de equivalencia es 7 ya que todos los iones han sido neutralizados.
Por otra parte, cuando la reacción ocurre entre una base fuerte y un ácido débil, el anión del ácido sufre una hidrólisis, por lo que el pH al que ocurre la neutralización es mayor que 7. Y en la situación contraria, entre ácido fuerte y una base débil, el catión de la base sufre una hidrólisis produciéndose iones hidrónio, por lo que el pH es menor que 7.
Para determinar éste punto (de equivalencia), podemos utilizar la curva de titulación potenciométrica de la reacción ácido-básica cuya gráfica resulta del pH del sistema contra volumen de ácido o de base agregados en la titulación (Umland, 2000, p.602).
En las titulaciones se pueden utilizar indicadores internos. Los indicadores son compuestos orgánicos de estructura compleja que cambian de color en solución a medida que cambia el pH. A continuación se describen algunos de ellos.
En las titulaciones se pueden utilizar indicadores internos. Los indicadores son compuestos orgánicos de estructura compleja que cambian de color en solución a medida que cambia el pH. A continuación se describen algunos de ellos.
En este tipo de titulaciones (con indicador interno) no se requiere de ningún gráfico para determinar el punto de equivalencia, solo se requiere observar el cambio de coloración de la solución para concluir el final de la reacción y hacer las mediciones correspondientes.
Las titulaciones potenciométricas al igual que en el caso anterior, son un proceso en el cual la solución estándar (del patrón primario) se combina con una solución de concentración desconocida para determinar dicha concentración, la curva de titulación es la gráfica que indica como el pH de la solución cambia durante el transcurso de la misma ( [*] el pH se gráfica contra el volumen de base o ácido agregado).
Para determinar el punto de equivalencia, podemos utilizar la curva de titulación potenciométrica de la reacción ácido-básica (Umland, 2000, p.602).
Como se observa, la concentración de los iones hidrónio, antes de agregar el ácido y comenzar la titulación corresponde a la concentración de iones hidrónio de la solución de la base débil. A medida que se agrega el ácido, la base débil se transforma en su sal, la solución contiene la base débil y la sal del ácido fuerte, y por consiguiente está amortiguada.
El primer punto de equivalencia corresponde a un volumen agregado de ácido, el cual ha neutralizado únicamente una carga del carbonato, y es hasta el segundo punto, donde el carbonato de sodio pierde sus propiedades. Está neutralizado. La valoración del carbonato sódico no puede realizarse con la exactitud que exige una normalización; por ello se valora siempre el segundo equivalente de hidrógeno (Ayres, 1970, p 334)
LABORATORIO YENKA
CONCLUSIÓN
Finalmente La titulación es un procedimiento importante pues es utilizado en química con el fin de determinar la molalidad de un ácido o una base . Una reacción química se establece entre un volumen conocido de una solución de concentración desconocida y un volumen conocido de una solución con una concentración conocida.
WEBGRAFIA
http://www.escuelapedia.com/el-papel-tornasol/
http://ciencia-basica-experimental.net/titulacion.htm
https://es.answers.yahoo.com/question/index?qid=20100131023924AAyM7VE
http://www.eis.uva.es/~qgintro/nomen/tutorial-09.html
https://doc-0g-80-docs.googleusercontent.com/docs/securesc/edpru4gqnm66brhavqak13fhvao4q4d8/lgq9fav7nuql1k6m625j62tn9tgom6uk/1541620800000/05285166965225682650/13836789518241930654/1B6NMCcVAYv1uuPBkKdrDPg_9bNTf6bkO?e=download&nonce=n3e1d6pd81rhe&user=09443605587336899398&hash=5tccng1v2rlcagb1e5enscjmh1j33t14
FALTARON EJERCICIOS DE NEUTRALIZACION 4,5
ResponderEliminar