INTRODUCCIÓN
Las reacciones químicas ocurren espontáneamente en el Universo, produciendo en forma lenta sustancias sencillas. En nuestro planeta, las reacciones químicas también suceden espontáneamente, pero de manera mucho más rápida y formando moléculas más complicadas, debido sobre todo a la presencia de oxígeno en el aire y en las aguas de mares, ríos y lagos.
REACCIÓN QUÍMICA
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos.
Una reacción química se produce cuando las sustancias participantes en ella se transforman en otras distintas.
A las primeras se les llama reactivos y a las segundas productos. La masa de las sustancias participantes es la misma antes y después de la reacción, es decir, se conserva.
Esto sucede porque sólo se lleva a cabo un re ordenamiento entre los átomos de los reactivos, que se rompen y forman nuevos enlaces.

Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.

CLASES DE REACCIONES QUÍMICAS
Combinación o síntesis
Se presentan cuando se unen dos o mas sustancias para formar otra sustancia, cuyas moléculas son el resultado de una re agrupación de átomos de los reactivos.
Es así que A +B → AB
Un ejemplo de esta reacción es la combinación de hidrógeno con oxígeno para producir agua:
2H2 + O2 → 2H2O

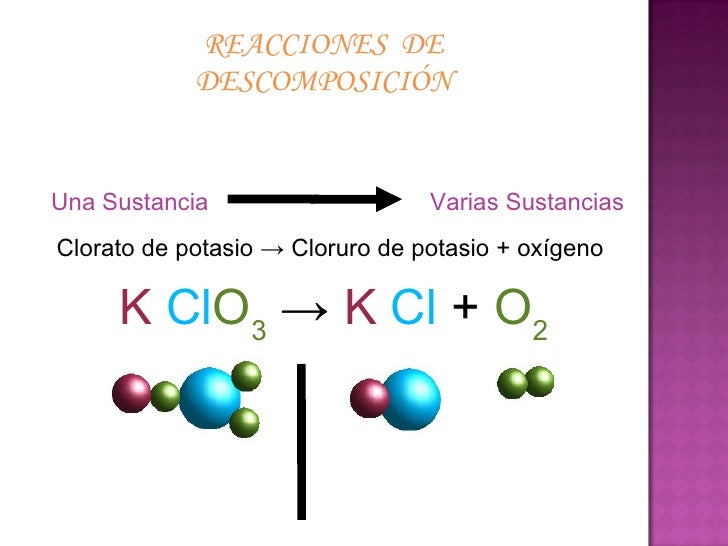
Descomposición
Ocurre cuando a partir de un compuesto se producen dos o mas sustancias.
AB → A + B
Como ejemplo tomamos a el carbonato de calcio que se descompone por medio de calentamiento
para producir oxido de calcio y dióxido de carbono.
CaCo3 → CaO + CO2
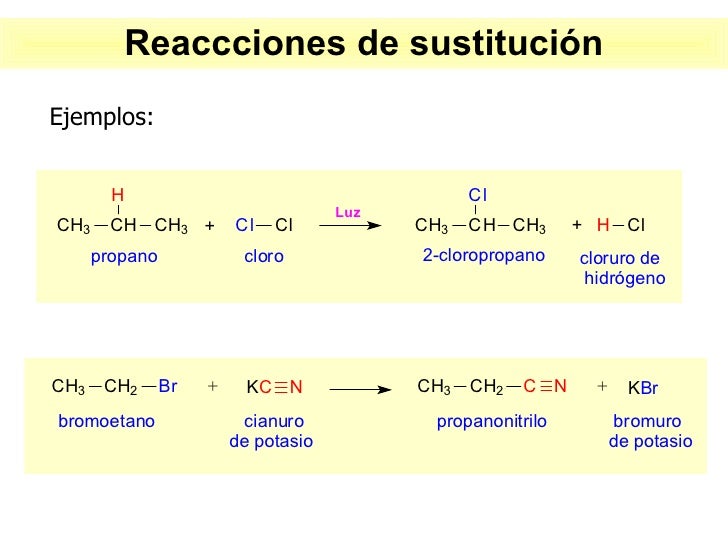
Desplazamiento o sustitución
En estas reacciones, un elemento sustituye y libera a otro elemento presente en el compuesto.
En este tipo se da que:
A + BC → AC + B
*Ejemplo:
El bromo líquido, que desplaza al yodo en el yoduro de sodio para producir bromuro de sodio dejando al yodo libre.
2NaI + Br2 → 2NaBr + I2
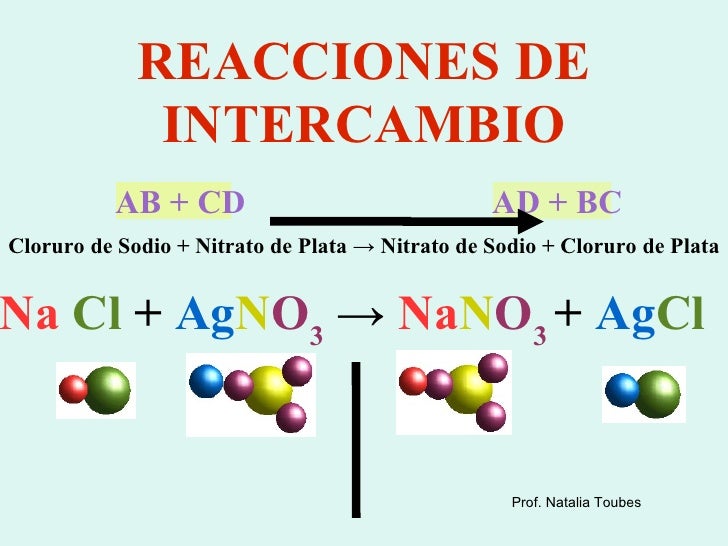
Intercambio o doble sustitución
Al reaccionar dos compuestos estos intercambian sus elementos y se producen dos nuevos compuestos.
Se representa de esta manera:
AB + CD → AC + BD
*Ejemplo:
HCl + NaOH → NaCl + H2O
Según el intercambio de calor
Según el intercambio de calor existen dos clases de reacciones las exotérmicas y las endotérmicas.
Las exotérmicas presentan desprendimiento de calor Se denomina reacción exotérmica a cualquier reacción química que desprenda energía, ya sea como luz o como calor.
Las endotérmicas absorben el calor.
*Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, gracias a la radiación ultravioleta proporcionada por la energía del Sol. También se produce esta reacción en las tormentas, en las proximidades de las descargas eléctricas.
3O2 + ENERGÍA da lugar a 2O3

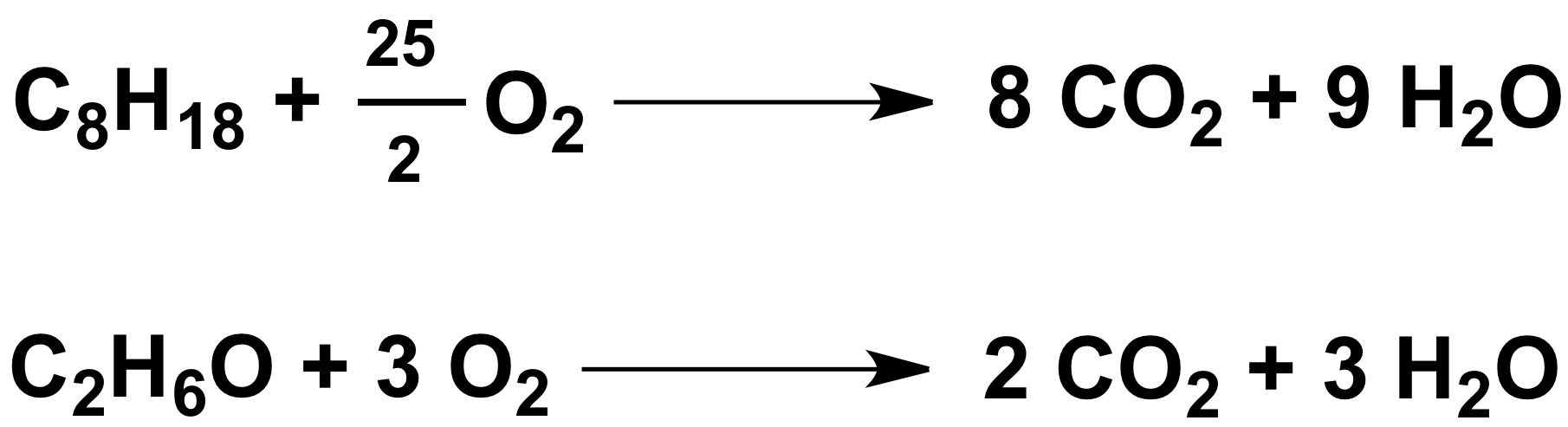
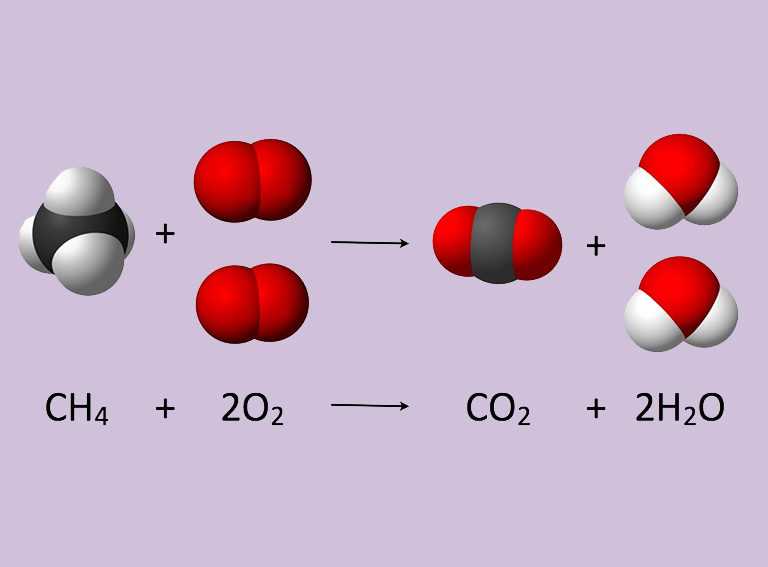
Reacción de combustión
La combustión es una reacción química de oxidación, en la cual generalmente se desprende una gran cantidad de energía, en forma de calor y luz, manifestándose visualmente como fuego.
En toda combustión existe un elemento que arde y otro que produce la combustión , generalmente oxígeno en forma de O2 gaseoso. Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno.
COMBUSTIBLE +O2 → H2O + CO2+ ENERGÍA.
ECUACIÓN QUÍMICA
Una
Las reacciones químicas se cumple la ley de conservación de la masa, teniendo lugar una re ordenación de los átomos, pero no su creación ni su destrucción. El re ordenamiento de los átomos en la molécula da lugar a una sustancia distinta.
Las sustancias que se transforman o modifican en una reacción se llaman reaccionan tes, reactivos o reactantes. Las sustancias nuevas que se originan en una reacción química se llaman productos.
Una de las reacciones químicas más usuales es la combustión del gas natural (mezcla de sustancias donde el metano, CH4, es el compuesto principal), cuya ecuación es:
Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación.
Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMÁTICO O ALGEBRAICO
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate.
De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

Continuamos: ¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el sub-índice encontrado a la derecha del paréntesis
final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos.
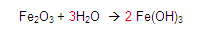
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
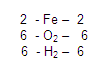
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
- 1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
- 2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
- 3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
- 4. Los alcalinos tienen en sus compuestos oxidación +1
- 5. Los alcalinotérreos tienen en sus compuestos oxidación +2
- 6. Los alógenos tienen en sus compuestos con aluros oxidación -1
- 7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
- 8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
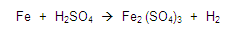
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
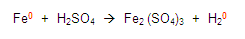
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
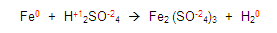
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
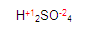
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
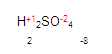
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
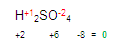
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
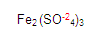
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
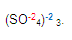
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
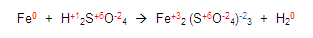
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
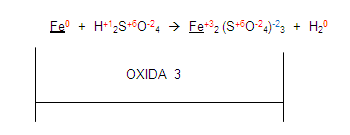
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
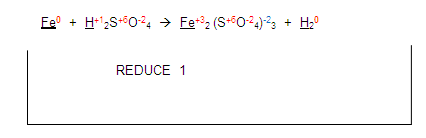
Entonces la ecuación queda de la siguiente manera:
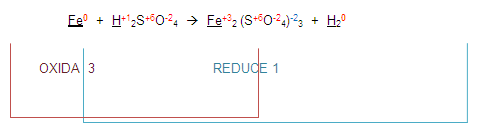
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
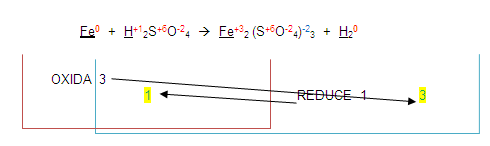
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
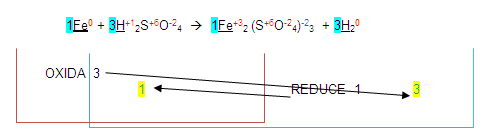
Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Con esto finalizamos el método de REDOX.
BALANCEO POR EL MÉTODO ALGEBRAICO/MATEMÁTICO
Se siguen los siguientes pasos:
- Escribir sobre cada molécula una literal, siguiendo el orden alfabético.
- Enlistar verticalmente los átomos que participan en la reacción
- A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encentra en cada molécula identificada por letra.
- Si de un lado de la reacción un elemento se encuentra en mas de una molécula, se suman y se escribe cuantas veces está presente en una molécula
- Se cambia la flecha por un signo igual =
- Se en listan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
- Los valores de las letras se obtienen por operaciones algebraicas
Ejemplo:
Balancear la siguiente ecuación:

Aplicamos el segundo paso:
Ca
C
O
H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto) a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto) 2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto) b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto) 2b = 2c + 2d
Le asignaremos el valor de "1" a C

El 1 no se escribe pero si notamos la literal "b" son dos literales "b" por lo tanto el valor que se ha
Obtenido es el mismo y solo se anota en lugar correspondiente.
¿Cómo se escribe una reacción química?

Se escribe en forma de ecuación sustituyendo el signo de igualdad (=) por una flecha (→) que indica el sentido de la misma.
Delante de cada fórmula se pone el número de unidades del elemento o del compuesto que intervienen en la reacción (excepto si ese número es 1) de manera que una vez completada, para cada elemento debe haber el mismo número de átomos en ambos términos. Por ejemplo, para indicar que cuando el carbono (C) se quema en presencia del oxígeno del aire (O2) se forma dióxido de carbono (CO2), se escribiría:
C + O2 → CO2
Si queremos escribir la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), pondremos:
2 H2 + O2 → 2 H2O
Y si queremos describir que la piedra caliza (carbonato de calcio: CaCO3) se descompone por el calor dando cal viva (óxido de calcio: CaO) y dióxido de carbono (CO2), tendríamos:
CaCO3 → CaO + CO2
CONCLUSION
Las reacciones químicas son un proceso en el que unas sustancias se transforman en otras por la reordenación de sus átomos mediante la rotura de unos enlaces en los reactivos y la formación de otros nuevos en los productos ademas las reacciones químicas son de suma importancia ya que son fenómenos que vemos a diario en nuestra vida y son la base de la realización de las funciones vitales y las demás actividades del hombre o cualquier otro ser vivo, como por ejemplo la respiración es una reacción química, ya que al organismo entra O2 y sale CO2. Además todas las sustancias que usamos o usan los demás seres vivos fueron producto de reacciones químicas.
WEBGRAFIA
https://clickmica.fundaciondescubre.es/conoce/100-preguntas-100-respuestas/se-escribe-una-reaccion-quimica/
https://www.definicionabc.com/ciencia/reaccion-quimica.php
https://portalacademico.cch.unam.mx/alumno/quimica1/unidad1/agua-compuesto-o-elemento/reacciones-quimicas
http://reaccionquimica04.blogspot.com.co/2012/11/clases-dereacciones-quimicas-podemos.html
http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
http://www.iered.org/archivos/Proyecto_coKREA/REAfinales2014/ReaccionesQuimicas_MagalyHenao/clases_de_reacciones_qumicas.html
http://www.lostipos.com/de/ecuaciones_quimicas.html
No hay comentarios:
Publicar un comentario