LABORATORIO GASES
INTRODUCCIÓN
El presente trabajo le mostrara las diferentes leyes que existen,para que usted pueda comprender y profundizar acerca del tema, en el siguiente informe se estudiara la ley de Boyle y Mariotte la ley de Charles Gay-lussac,gases ideales y ley generalizada de los gases.
OBJETIVO GENERAL
Explicar de manera especifica la teoría y ejercicios de las leyes de los gases.
OBJETIVOS ESPECIFICO
Describir conceptos básicos en el desarrollo de los ejercicios
Reconocer las leyes a la hora de aplicarlos en ejercicios
MARCO TEÓRICO
CONCEPTOS BÁSICOS:Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia
En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
Temperatura
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
PRESIÓN
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
1atm=760mmHg
Volumen
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
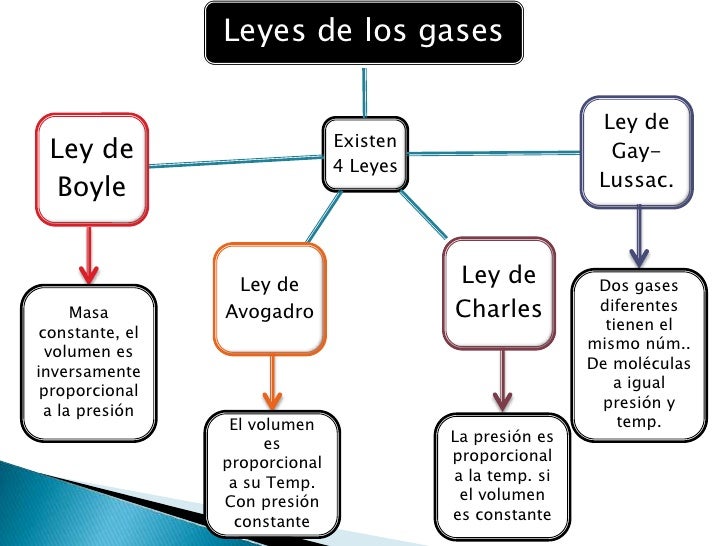
Ley de Boyle
Relación entre la presión y el volumen de un gas cuando la temperatura es constante
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
Explicación de la ley de Boyle
La presión aplicada a un gas es inversamente proporcional a su volumen a temperatura y numero de moles (cantidad de gas) constante. Es decir que si se aumenta del doble la presión ejercida sobre el gas, este se comprime reduciendo su volumen a la mitad. Si la presión es 3 veces superior, el volumen sera de un tercio.
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que éste ejerce.
Esta fórmula se puede utilizar para determinar el cambio de presión o temperatura durante una transformación isotérmica de la siguiente manera:
P1 · V1 = P2 · V2
Es decir, que el producto entre la presión inicial y el volumen inicial es igual al producto de la presión final por el volumen final. Por ejemplo, si se desea determinar el volumen final, será suficiente dividir P1V1 entre P2.
(P1 · V1)/ P2 = V2
Como se puede observar en la siguiente animación, cuando aumenta la presión, el volumen baja y viceversa.
Ejercicio sobre la ley de Boyle
1) Un determinado gas con una presión de 1,8 atm ocupa un volumen de 0,9L. Manteniendo constantes
la temperatura, se aumenta la presión del gas a 4,1 atm. Calcular el volumen ocupado por el gas.
Teniendo en cuenta la fórmula de la ley de Boyle planteada anteriormente P1 · V1 = P2 · V2 se realizan los cálculos necesarios.
(P1 · V1)/ P2 = V2
(1,8atm · 0,9L)/ 4,1atm = V2 = 0,395L
Respuesta: El nuevo volumen ocupado por el gas será 0,395L
Ley de Charles
Relación entre la temperatura y el volumen de un gas cuando la presión es constante
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
VT=k
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
V1T1=V2T2
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Cuando se desean estudiar dos diferentes estados, uno inicial y una final de un gas y evaluar el cambio de volumen en función de la temperatura o viceversa, se puede utilizar la fórmula:
V1 / T1 = V2 / T2
y despejar según la incognita que se desee resolver.
Gráficos sobre la ley de Charles
Ejercicio sobre la ley de Charles
1) Si se tienen 0,2 litros de un gas a 30 °C y 1 atm de presión ¿Qué temperatura debería alcanzar para que aumente a 0,3 litros?
Los datos son:
V1 = 0,2L
T1 = 30 °C = 303,15 K (que se obtiene sumando 30 + 273,15)
P1 = P2 = 1 atm
V2 = o,3L
T2 = ?
T1 . V2 / V1 = T2
(303,15 K . 0.3L) / 0,2L = T2 = 454,7 K = (454,7 – 273,15) = 181,55°C
Ley de Gay-Lussac
Relación entre la presión y la temperatura de un gas cuando el volumen es constante
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
¿Por qué ocurre esto?
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
PT=k
(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
P1T1=P2T2
que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Explicación de la ley de Gay-Lussac
Joseph Louis Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin).
La presión del gas es directamente proporcional a su temperatura
Es decir que:
Si la temperatura aumenta la presión aumenta
Si la temperatura disminuye la presión disminuye
Ejercicio sobre la ley de Charles
1) Un gas ocupa un recipiente de 1,5 litros de volumen constante y ha llegado a la temperatura de 179°C y una presion de 770 mmHg. La temperatura inicial era de 50ºC ¿A qué presión se encontraba el gas inicialmente ?
P1 / T1 = P2 / T2
de la cual se debe despejar P1
P1 = (P2 / T2) . T1
(770/452,15) . 323,15 = 550,3 mmHg = P1
LEY DE LOS GASES IDEALES
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptista van Helmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
 donde k es constante si la temperatura y la masa del gas permanecen constantes.
donde k es constante si la temperatura y la masa del gas permanecen constantes.Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
En este siglo, los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.
Ecuación de estado
El estado de una cantidad de gas se determina por su presión, volumen y temperatura. La forma moderna de la ecuación relaciona estos simplemente en dos formas principales. La temperatura utilizada en la ecuación de estado es una temperatura absoluta: en el sistema SI de unidades, kelvin, en el sistema imperial, grados Rankine.7
Forma común
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:

Donde:
P\! = Presión absoluta
V\! = Volumen
n\! = Moles de gas
R\! = Constante universal de los gases ideales
T\! = Temperatura absoluta
El estado de una cantidad de gas se determina por su presión, volumen y temperatura. La forma moderna de la ecuación relaciona estos simplemente en dos formas principales. La temperatura utilizada en la ecuación de estado es una temperatura absoluta: en el sistema SI de unidades, kelvin, en el sistema imperial, grados Rankine.7
Forma común
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:

Donde:
P\! = Presión absoluta
V\! = Volumen
n\! = Moles de gas
R\! = Constante universal de los gases ideales
T\! = Temperatura absoluta
Ecuación general de los gases ideales
Partiendo de la ecuación de estado:
Tenemos que:
Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2:
Para una misma masa gaseosa (por tanto, el número de moles «n» es constante), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.
El producto PV es directamente proporcional a la temperatura del gas y si T es constante, P y V son inversamente proporcionales.
EJERCICIOS
LEY BOYLE
LEY DE CHARLES
LEY DE GAY-LUSSAC
GASES IDEALES
LABORATORIO



 BIOGRAFIAS
BIOGRAFIAS
Nacido en 1627, el menor de los catorce hijos del conde de Cork, estudió en las mejores universidades de Europa. Descubrió los indicadores, sustancias que permiten distinguir los ácidos de las bases. En 1659, con la ayuda de Robert Hooke, descubrió la ley que rige el comportamiento de los muelles, perfeccionó la bomba de aire para hacer el vacío que se utilizó en la minería para eliminar el agua de las galerías en las que trabajan los mineros.
Atacó a la Alquimia y a los alquimistas, que anunciaban que podían convertir cualquier metal en oro.
Definió la Química como una ciencia y enunció la primera definición moderna de elemento químico, como sustancia que no es posible descomponer en otras.
En 1661 publicó el primer libro moderno de química El Químico Escéptico en el que explicaba la mayoría de sus descubrimientos. Fue miembro de la Royal Society, institución que perdura en la actualidad, y participó activamente en sus reuniones hasta su fallecimiento.
En 1660, en una obra titulada Sobre la Elasticidad del Aire anunció su descubrimiento sobre la relación entre el volumen de un gas y su presión.
Parece que Boyle no especificó en sus trabajos que sus experiencias de la relación entre el volumen y presión los realiza a temperatura constante, quizá porque lo hizo así y lo dió por supuesto. Lo cierto es que, en defensa del rigor científico, hay que esperar a que en 1676 otro físico, el francés Edme Mariotte (1630-1684), encuentre de nuevo los mismos resultados y aclare que la relación PV=constante es sólo válida si se mantiene constante la temperatura. Por eso la ley de Boyle está referenciada en muchas ocasiones como Ley de Boyle y Mariotte.
Jacques Charles (1746-1823)

Jacques Alexandre César Charles, químico, físico y aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión observó que por cada grado centígrado de aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto.
Charles no público sus experimentos y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión por lo que a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.
Joseph Louis Gay-Lussac (1778-1850)
Químico y físico francés, nacido el 6 de diciembre de 1778, en Saint-Léonard-de-Noblat, y fallecido el 9 de mayo de 1850, en París.
Además de ocupar cargos políticos de importancia, Gay-Lussac fue catedrático de Física (a partir de 1808) en la Universidad de la Sorbona, así como catedrático de Química (a partir de 1809) en el Instituto Politécnico de París.
En 1802 publicó los resultados de sus experimentos que, ahora conocemos como Ley de Gay-Lussac. Esta ley establece, que, a volumen constante, la presión de una masa fija de un gas dado es directamente proporcional a la temperatura Kelvin.
En el campo de la física llevó a cabo, en 1804, dos ascensiones en globo, hasta altitudes de 7.000 metros, en las que estudió la composición de las capas altas de la atmósfera y el magnetismo terrestre.
Entre 1805 y 1808 dió a conocer la ley de los volúmenes de combinación, que afirma que los volúmenes de los gases que intervienen en una reacción química (tanto de reactivos como de productos) están en la proporción de números enteros sencillos.
En relación con estos estudios, investigó junto con el naturalista alemán Alexander von Humboldt, la composición del agua, descubriendo que se compone de dos partes de hidrógeno por una de oxígeno.
En 1811 dió forma a la ley que Charles había descubierto en 1787 sobre la relación entre el volumen y la temperatura, pero que había quedado sin publicar. Este mismo año, el químico francés Courtois, por medio de una reacción química produjo un gas de color violeta que Gay-Lussac identificó como un nuevo elemento y le dio el nombre de yodo, que en griego significa violeta.
Estudió también el ácido cianhídrico así como el gas de hulla. En el año 1835 creó un procedimiento para la producción de ácido sulfúrico basado en el empleo de la torre llamada de Gay-Lussac.
Gracias a sus mediciones químicas de precisión y a sus procedimientos exactos de trabajo, logró obtener varios elementos químicos y establecer las bases del análisis volumétrico convirtiéndolo en una disciplina independiente.
En la lucha de prestigio entre Francia e Inglaterra, Napoleón suministró fondos a Gay-Lussac para que construyera una batería eléctrica mayor que la de Davy, y así encontrar nuevos elementos.
La batería no fue necesaria, pues Gay-Lussac y Thenard empleando el potasio descubierto por Davy, aislaron el boro sin necesidad de la electricidad. Al tratar óxido de boro con potasio se produjo el elemento boro.
En 1809 Gay-Lussac trabajó en la preparación del potasio e investigó las propiedades del cloro. En el campo de la industria química desarrolló mejoras en varios procesos de fabricación y ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del Senado.
CONCLUSIÓN
El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos.
WEBGRAFIA
http://www.educaplus.org/gases/bio_gay.html
ttps://www.monografias.com/trabajos91/leyes-gases-quimica/leyes-gases-quimica.shtml
https://iquimicas.com/ley-boyle-leyes-los-gases/
https://www.google.com.co/search?q=LEYE+DE+BOYLE&rlz=1C1AVNC_enCO769CO769&oq=LEYE+DE+BOYLE&aqs=chrome..69i57j69i60j69i61j0l3.2441j0j9&sourceid=chrome&ie=UTF-8








FALTO PANTALLAZOS A LOS EJERCICIOS 4.0
ResponderEliminar