INTRODUCCIÓN
En este trabajo se mostrara información acerca del balanceo de ecuaciones químicas y procedimientos para poderlas desarrollar
partes que conforman una ecuación química, así como la ley de conservación de la materia que a continuación se mencionara. Lo que quiere decir es que los átomos en una ecuación química se reorganizan, obteniendo el mismo número de átomos en los reactivos y productos.
OBJETIVO GENERAL
Aprender y reconocer los métodos para balancear las ecuaciones:tanteo y oxido reducción
OBJETIVOS ESPECÍFICOS
1 conocer los coeficientes que balancean la ecuación, estos coeficientes indican las relaciones molares que se guardan entre las sustancias,
2 hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos.
desarrollar las ecuaciones de la pagina Laboratorio virtual de balanceo de ecuaciones.
MARCO TEÓRICO
Balancear una ecuación química es igualar el número y clase de átomos, iones o moléculas reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa.
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas para indicar la cantidad de elementos o compuestos que intervienen en la reacción química.
No deben confundirse con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia.
Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
Para balancear una ecuación química, se debe considerar lo siguiente:
Conocer las sustancias reaccionantes y productos.
Los subíndices indican la cantidad del átomo indicado en la molécula.
Los coeficientes afectan a toda la sustancia que preceden.
El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua .
MÉTODO POR TANTEO
Se emplea para balancear ecuaciones sencillas. Se realiza al "cálculo" tratando de igualar ambos miembros.
Para ello utilizaremos el siguiente ejemplo para balancear:
N2 + H2 -- NH3
Identificamos las sustancias que intervienen en la reacción.
En este caso el nitrógeno y el hidrógeno para obtener amoniaco.
Se verifica si la ecuación está balanceada o no. En este caso notamos que ambos miembros no tienen la misma cantidad de átomos, por lo tanto no está balanceada.
Se balancea la ecuación colocando coeficientes delante de las fórmulas o símbolos que los necesitan. Empezar con los elementos metálicos o por el que se encuentra presente en menos sustancias: Primero balanceamos el nitrógeno:
N2 + H2 -- 2 NH3
El hidrógeno y oxígeno quedarán para el final. Seguidamente balanceamos el hidrógeno:
N2 + 3 H2 -- 2 NH3.
Si un coeficiente no es entero, entonces debe multiplicar todos por el mayor de los denominadores. En este caso no ocurre. Como es un tanteo, debe recordar que las reglas indicadas, son recomendaciones. Aún así, para cualquier ejercicio, empiece usted, por donde desee pero tomando como parámetro que el número de átomos de este elemento está definido en uno de los miembros.
Balancear:
Al(OH)3 + H2SO4 -- Al2(SO4)3 + H2O
Primero balanceamos el metal aluminio: 2 Al(OH)3 + H2SO4 -- Al2(SO4)3 + H2O
Luego seguimos con el azufre: 2 Al(OH)3 + 3 H2SO4 -- Al2(SO4)3 + H2O
Finalmente continuamos con el hidrógeno, el oxígeno resulta balanceado automáticamente:
2 Al(OH)3 + 3 H2SO4 -- Al2(SO4)3 + 6 H2O

MÉTODO OXIDO REDUCCIÓN
El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
Las reglas para introducir las ecuaciones
- Los espacios entre los símbolos y las fórmulas se ignoran, por ejemplo: Cu SO 4 es idéntico CuSO4
- Se permite el uso de todos tipos de paréntesis, como por ejemplo: K3[Fe(CN)6]
- Cuando se escriben iones, añadan simplemente la carga al final de la fórmula, como por ejemplo: Hg2+, Hg22+ o Hg2^2+
- Como flecha en la ecuación pueden utilizar la señal "=" o "-->" o "→".
- La entera ecuación se puede escribir con minúsculas. Los elementos, escritos correctamente (la primera letra escrita con mayúscula) el convertidor dejará sin cambios, de mismo modo como lo han escrito ustedes.
¿Por qué tenemos que equilibrar la reacción química?
La ecuación química equilibrada describe exactamente las cantidades de los reactantes y productos en una reacción química. La ley sobre la conservación de la masa dice que en la reacción química la masa no se puede ni producir ni destruir. Esto significa que la ecuación química debe tener por ambos lados el mismo número de átomos de cada elemento. Para que una ecuación esté equilibrada, las sumas de las cargas eléctricas en ambos lados tienen que ser idénticas.
Instrucciones para equilibrar las ecuaciones redox
- Paso 1. Se escribe una reacción desequilibrada
- Paso 2. Se desmonta la reacción redox a las reacciones parciales
- a) Se determinan los números de la oxidación de cada átomo respectivo.
- b) Se identifican los pares redox en la reacción
- c) Se combinan los pares redox en dos reacciones parciales
- Paso 3. Se equilibran los átomos en las ecuaciones parciales
- a) Se equilibran todos los átomos excepto del H y del O
- b) Se equilibran las cargas añadiendo H+ o OH-
- b) Se equilibran los átomos del oxígeno añadiendo H2O
- Paso 4: Se iguala el número de los electrones perdidos y recibidos en las reacciones parciales
- Paso 5: Se suman las ecuaciones parciales
- Paso 6: Se acorta la ecuación
- Y al final, siempre se verifica el equilibrio de las cargas y de los elementos.

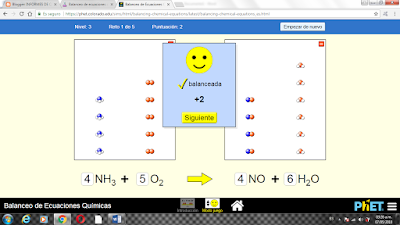
ECUACIONES LABORATORIO QUÍMICO DE ECUACIONES
NIVEL 1
NIVEL 2
NIVEL 3
CONCLUSIÓN
Al concluir esta investigación seremos capaces de balancear correctamente cualquier ecuación química por el proceso de tanteo y oxido reducción , así como
también podremos reconocer si una ecuación química se encuentra correctamente balanceada.
también podremos reconocer si una ecuación química se encuentra correctamente balanceada.
webgrafia
https://phet.colorado.edu/sims/html/balancing-chemical-equations/latest/balancing-chemical-equations_es.html
http://html.rincondelvago.com/balanceo-de-ecuaciones-quimicas.html
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Balanceo_de_ecuaciones
http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=248





















FALTO MAS CONSULTA PARA LOS MARCOS TEORICOS Y MAS OPCIONES DE LOS NIVELES DEL JUEGO DE BALANCEO 4.0
ResponderEliminarNIVELACION 4.8
ResponderEliminar